Quando un elettrolita si dice forte?
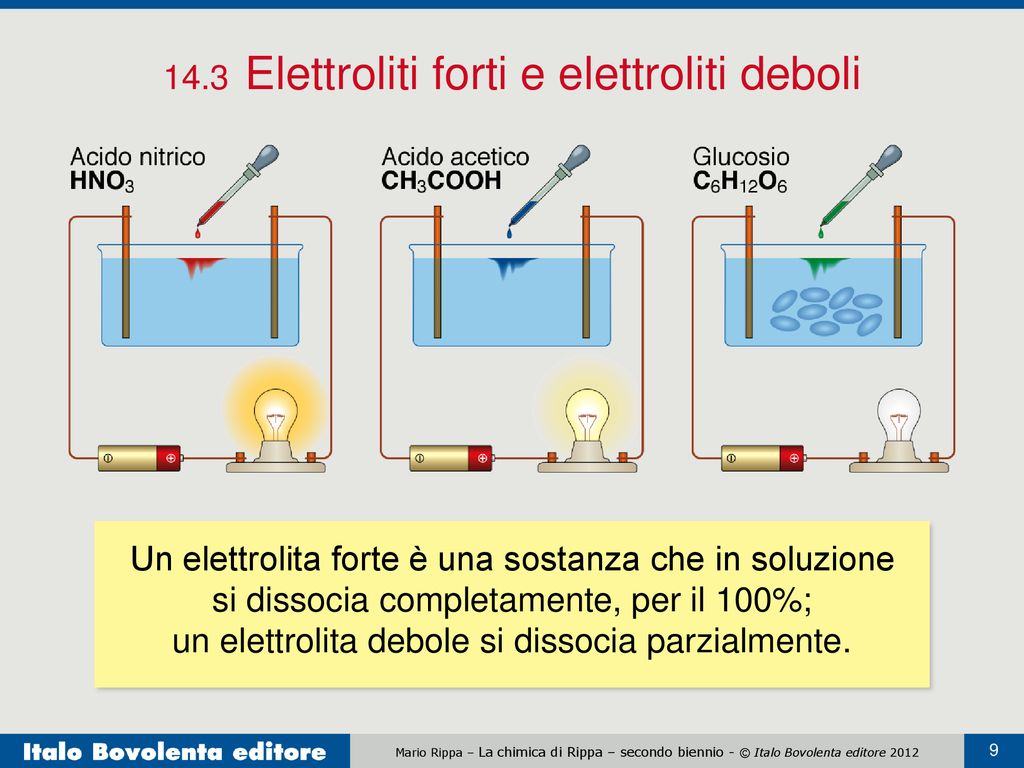
Un elettrolita in una soluzione può essere descritto concentrato se ha un’alta concentrazione di ioni, o diluito se ha una bassa concentrazione. Se un’alta proporzione del soluto si dissocia per formare ioni liberi, l’elettrolita è forte; se la maggior parte del soluto non si dissocia, l’elettrolita è debole

Sono elettroliti forti tutti i sali (ad eccezione di pochi sali del Cd), alcuni acidi e alcune basi (indicati come acidi forti e basi forti); gli elettroliti deboli sono soltanto acidi e basi (indicati come acidi deboli e basi deboli).
Come capire se ho un elettrolita?
Quando un soluto si dissocia in acqua per dare ioni esso viene detto elettrolita e la soluzione diventa quindi una buona conduttrice di elettricità. Nel caso che il soluto non dia luogo a formazione di ioni esso è detto non-elettrolita e le soluzioni che lo contengono non conducono elettricità.
Come si fa la dissociazione elettrolitica?

Acqua + NaCl
L’acqua è in grado di provocare la ionizzazione di molecole polari, cioè la loro scomposizione in ioni e la successiva dissociazione elettrolitica. I composti ionici e i composti molecolari contenenti legami covalenti eteropolari piuttosto polarizzati in acqua si ionizzano, cioè si generano degli ioni.
Quando una soluzione e elettrolita?
Gli elettroliti – al singolare: elettrolita – si definiscono come: le sostanze prodotte in una soluzione elettricamente conduttiva e disciolte in un solvente polare, ad esempio l’acqua.
Che cosa si intende per dissociazione ionica?
Dissociazione ionica – M. Taglioni. Il processo che si verifica durante la dissoluzione di sostanze ioniche in acqua prende il nome di dissociazione ionica. La presenza di una sostanza ionica conferisce all’acqua una proprietà nuova: quella di condurre la corrente elettrica.
LA FORZA DI UN ELETTROLITA
si dissocia, se era costituito da ioni …
Le persone hanno chiesto anche
Quali sono gli elettroliti forti e deboli?
Vorrei avere delucidazioni su questa domanda di chimica: Quando un elettrolita si dice forte? A)Quando ha molte cariche
Come si fa la dissociazione ionica?
La maggior parte dei composti chimici inorganici, quando vengono sciolti in acqua, si separano in ioni: una parte positiva, detta catione ed una parte negativa detta anione. Anche alcuni composti organici possono separarsi in ioni, come ad esempio i sali derivati dagli acidi carbossilici.
Come faccio a sapere se un composto si dissocia o no?
Allorché un elettrolita passa in soluzione si dice che:
- si dissocia, se era costituito da ioni ancor prima di passare in soluzione (è il caso di Na+Cl-);
- si ionizza se prima di passare in soluzione era costituito da molecole (è il caso del cloruro di idrogeno, HCl).
Come si fa a capire se un elettrolita è forte o debole?
Gli elettroliti
Se la scissione è completa o quasi l’elettrolita è forte, ma se è parziale l’elettrolita è debole, e rimane in gran parte in soluzione sotto forma non dissociata. Tra gli elettroliti forti ci sono quasi tutti i sali, e alcuni acidi e basi, che sono considerati acidi forti e basi forti.
Come riconoscere un elettrolita forte o debole?
In riferimento ad una soluzione, un elettrolita forte è presente in un’unica fase liquida allo stato di ioni solvatati. Un elettrolita debole è un elettrolita che si dissocia in acqua solo parzialmente.
Quali sostanze sono Elettrolite?

Gli elettroliti sono minerali che si trovano nei liquidi del corpo (sangue, urine e altri) sotto forma di ioni positivi (cationi), principalmente sodio, potassio, calcio e magnesio, e di ioni negativi (anioni), soprattutto cloruri, bicarbonati e fosfati.
Che differenza c’è tra un processo di dissociazione elettrolitica è un processo di ionizzazione?
Nella dissociazione ionica le mo- lecole d’acqua separano ioni positivi (Na+) e negativi (Cl–) già presenti nel composto ionico; nella ionizzazione le molecole d’acqua trasformano mo- lecole polari (come HCl) in ioni (che prima non esistevano).
Come fare la dissociazione in chimica?
Nella rappresentazione della dissociazione (o pi precisamente ionizzazione) la formula del residuo acido si scrive riportando dopo il simbolo dello zolfo i quattro atomi di ossigeno indicando, a destra in alto, le due cariche negative senza specificare su quali dei due atomi sono collocate.
Cosa si intende per prima dissociazione?
La dissociazione in chimica è la scissione parziale o completa di una molecola. A seconda delle modalità e condizioni in cui avviene la scissione, la dissociazione di una sostanza è in grado di produrre specie ioniche (cationi e anioni), radicaliche oppure molecole neutre a più basso peso molecolare.
Come fare acqua con elettroliti?
Come preparare una bevanda elettrolitica?
- Mettere 1 tazza di acqua sul fornello;
- Aggiungere un cucchiaino di polvere zenzero o, in alternativa, uno di polvere di curcuma;
- Far bollire per circa 5 minuti e poi filtrare l’infuso;
- Aggiungere il magnesio assoluto;
- Aggiungere il succo di limone, il sale e il miele;
Come si comportano i sali in acqua?
I sali sono composti che in soluzione acquosa esistono dissociati nei loro ioni. Tali ioni, se provenienti da acidi deboli o da basi deboli, reagiscono con le molecole dell’acqua, comportandosi da acidi o da basi di Bronsted più o meno forti. L’interazione tra sali e acqua viene detta idròlisi.
In che modo avviene la ionizzazione dell’acqua?
Quando la comune acqua del rubinetto entra nello Ionizzatore, i minerali positivi alcalini e quelli negativi acidi sono mescolati insieme. Il processo di ionizzazione attira in una camera solo i minerali alcalini, e nell’altra solo quelli acidi.
Come sono chiamate le soluzioni elettrolitiche?
soluzioni ioniche ( chiamate anche soluzioni elettrolitiche ).
Quando prendere gli elettroliti?
A seconda dell’attività sportiva e dall’ambiente in cui viene svolta può essere necessario integrare questi elementi tramite specifiche bevande tecniche. In condizioni di temperatura e umidità elevate, la sudorazione diventa molto abbondante anche quando non si svolgono attività particolarmente lunghe o intense.
Quali tra le seguenti sostanze è un elettrolita debole?
Quale delle seguenti sostanze è un elettrolita debole? l’acido acetico, infatti la reazione di dissociazione di CH3COOH è una tipica reazione di equilibrio.
Perché la soluzione di un elettrolita Bolle a temperatura più alta?
Un liquido entra in ebollizione quando la sua tensione di vapore uguaglia la pressione atmosferica. Quando a un solvente puro aggiungiamo un soluto non volatile si ha un abbassamento della tensione di vapore. Ciò rende necessaria una temperatura di ebollizione più elevata rispetto a quella del solvente puro.
Quale di queste sostanze è un elettrolita debole?
Quali soluzioni conducono corrente?
Le sostanze le cui soluzioni conducono elettricità sono dette elettroliti; tutti i composti ionici solubili sono elettroliti forti , tipici esempi di elettroliti sono KBr, NaCl, HI ecc.
Cosa vuol dire neutralizzare una soluzione?
Una reazione di neutralizzazione può essere schematizzata come:
- acido + base → sale + acqua.
- HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
- H+(aq) + Cl–(aq) + Na+(aq) + OH–(aq) → Na+(aq) + Cl–(aq) + H2O(l)
- H+(aq) + OH–(aq) → H2O(l)
- 2 H3PO4(aq) + 3 Ca(OH)2(aq) → Ca3(PO4)2(s) + 6 H2O(l)
- NaF → Na+ + F–
Quando un composto si dissocia in acqua?
Quando un composto ionico si scioglie in acqua, ogni ione negativo viene circondato da molecole di acqua che si orientano verso di esso con l’estremità positiva ed ogni ione positivo viene circondato da molecole di acqua che si orientano verso di esso con l’estremità negativa.
Come si fa a capire se un composto e acido o basico?
I valori del pH variano da 0 a 14. Se pH è maggiore di 7 la soluzione è basica. Se pH è uguale a 7 la soluzione è neutra. Se pH è minore di 7 la soluzione è acida.
Quali elementi si dissociano in ioni?
Sono definiti elettroliti quei composti chimici che in soluzione acquosa si dissociano parzialmente o totalmente in ioni positivi e negativi. Essi comprendono i sali, gli acidi e le basi.
Come capire elettrolita forte?
Come si riconosce un elettrolita?
Elettrolita – Chimica-online
Elettrolita, non elettrolita e grado di dissociazione … Allorché un elettrolita passa in soluzione si dice che:
Stai guardando: Quando un elettrolita si dice forte?
Fonte: townhouserome
Categoria: Qual è lo