Guida alla scrittura della configurazione elettronica degli elementi
La configurazione elettronica di un atomo fornisce una rappresentazione numerica degli orbitali che lo compongono. Gli orbitali, che possono assumere diverse forme e posizioni rispetto al nucleo, rappresentano l’area di maggiore probabilità in cui è possibile individuare un elettrone. Questa rappresentazione fornisce informazioni sulla quantità di elettroni presenti in ciascun orbitale, consentendo di stabilire rapidamente quanti orbitali contiene un atomo.

Comprendere i principi di base che sottendono alla configurazione elettronica è fondamentale per essere in grado di scriverla correttamente e con precisione. Una volta acquisita questa conoscenza, sarete in grado di affrontare con maggiore sicurezza gli esami di chimica che richiedono la padronanza della configurazione elettronica.
Trovare il numero atomico
Per identificare il numero atomico di un atomo, è necessario conoscere il numero di protoni presenti nel nucleo dell’atomo. Il numero atomico è un valore intero positivo e corrisponde al numero di protoni contenuti nell’atomo. Ad esempio, l’idrogeno ha un numero atomico di 1, mentre il numero atomico del sodio è 11. Inoltre, in un atomo neutro, il numero di elettroni è uguale al numero atomico.
Determinare la carica dell’atomo
Se l’atomo ha una carica diversa da zero, significa che ha guadagnato o perso elettroni. Per determinare la carica dell’atomo, bisogna sapere il numero di elettroni dell’atomo neutro e il numero di elettroni aggiunti o persi. Ad esempio, un atomo di sodio con una carica negativa di -1 ha guadagnato un elettrone in più rispetto all’atomo neutro e avrà quindi un totale di 12 elettroni.
Gli orbitali
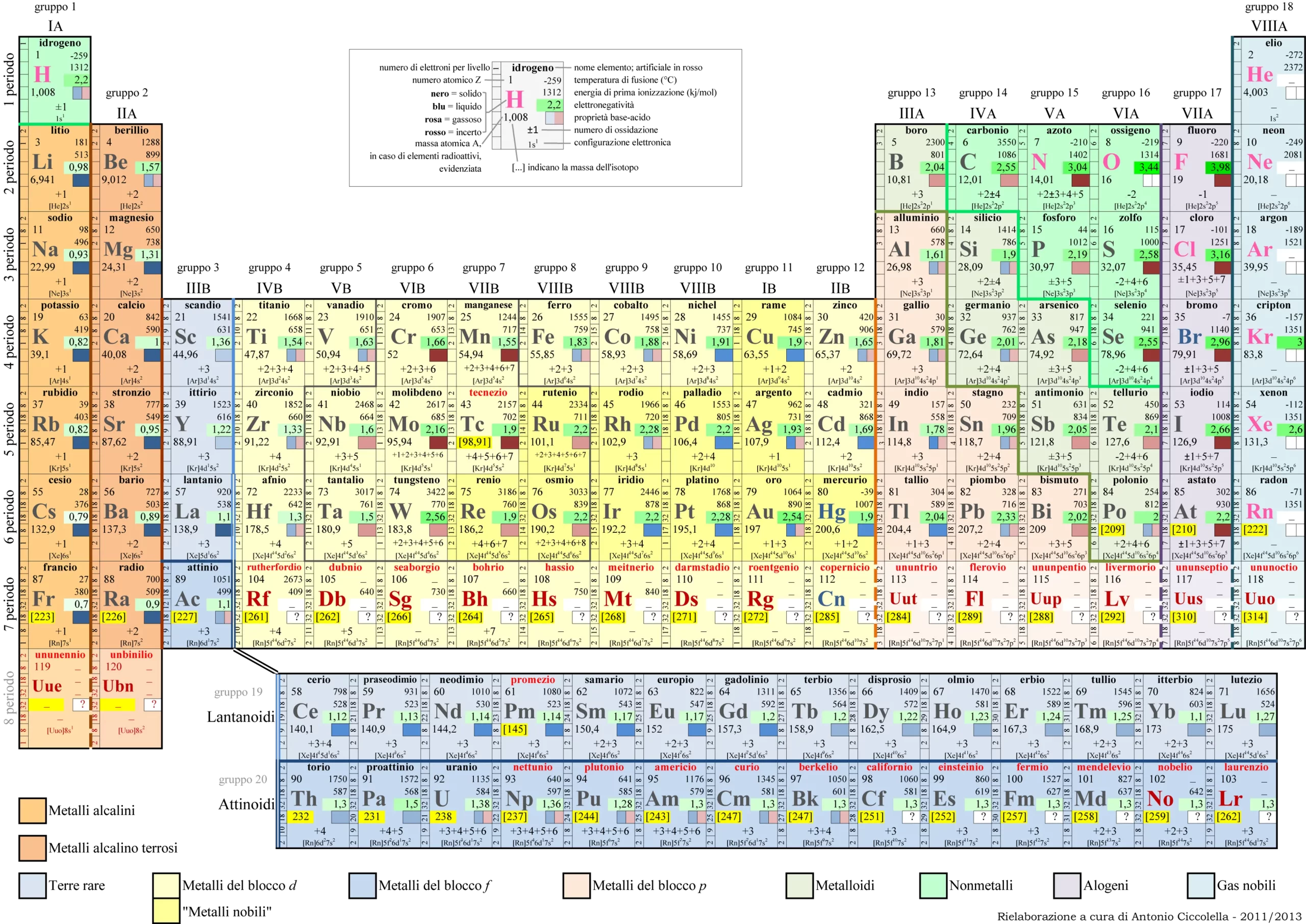
Gli orbitali sono regioni in cui gli elettroni possono essere trovati all’interno di un atomo. Esistono quattro gruppi principali di orbitali, ovvero gli orbitali di tipo s, p, d e f. Gli orbitali di tipo s possono contenere al massimo 2 elettroni, mentre quelli di tipo p possono contenere al massimo 6 elettroni. Gli orbitali di tipo d e f possono contenere rispettivamente un massimo di 10 e 14 elettroni.
La configurazione elettronica
La configurazione elettronica di un atomo è una rappresentazione del modo in cui gli elettroni sono distribuiti all’interno degli orbitali dell’atomo. Viene scritta in base alla sequenza degli orbitali e al numero di elettroni presenti in ciascun orbitale. Ad esempio, la configurazione elettronica dell’atomo di neon è 1s2 2s2 2p6, il che significa che l’atomo di neon ha due elettroni nell’orbitale 1s, due elettroni nell’orbitale 2s e sei elettroni nell’orbitale 2p, per un totale di 10 elettroni.
Configurazione elettronica – YouTube
L’Ordine degli Orbitali
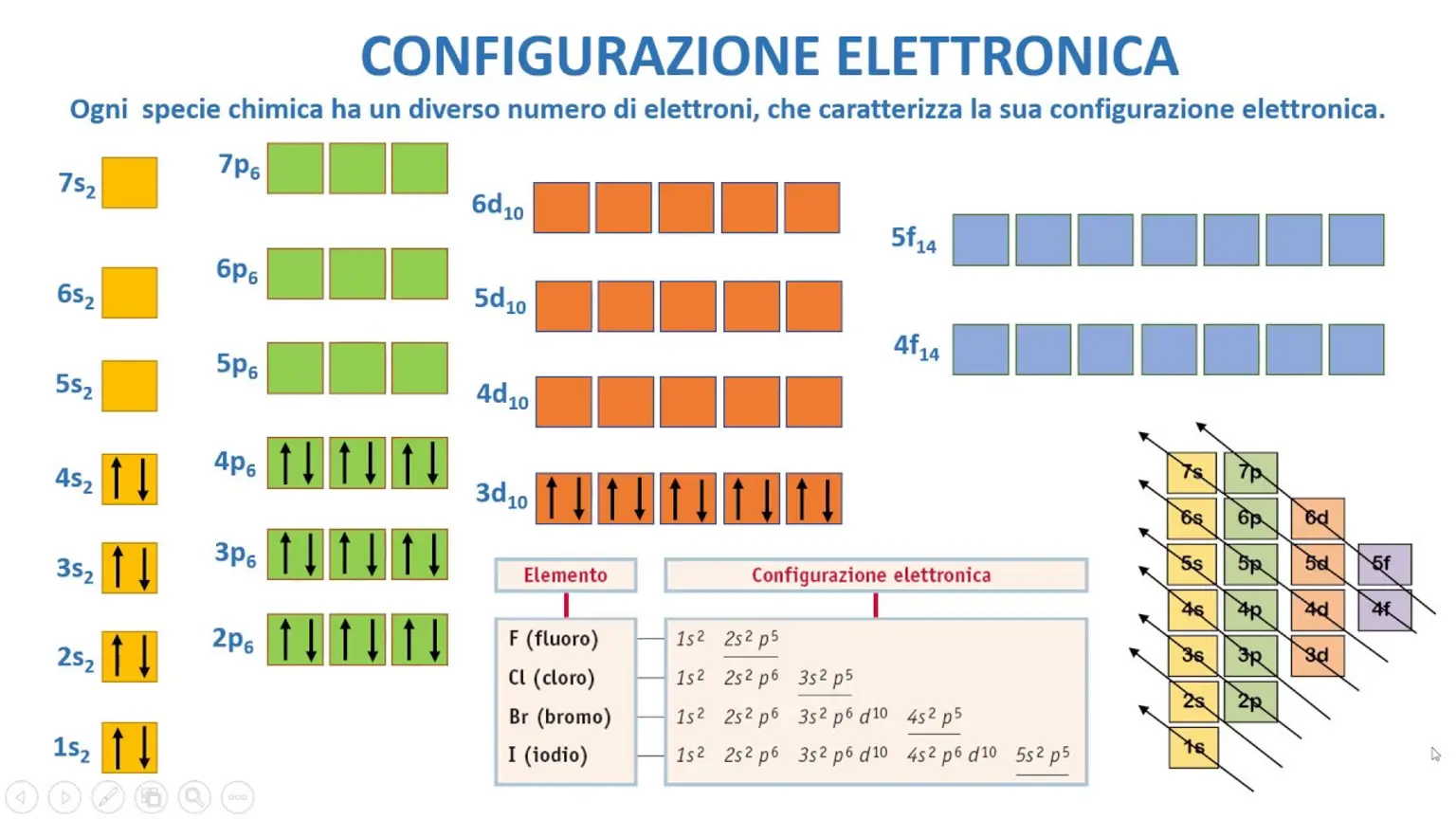
Per scrivere correttamente la configurazione elettronica di un atomo, è importante conoscere l’ordine degli orbitali. Gli orbitali sono suddivisi in gruppi numerati in base al guscio elettronico, ma ordinati in base all’energia. L’ordine degli orbitali è il seguente: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
Esempio di Configurazione Elettronica Completa
Una configurazione elettronica completa per un atomo con tutti gli orbitali occupati sarebbe scritta come: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d107p68s2. Questa configurazione elettronica rappresenta l’ununoctio (Uuo), che ha il numero atomico 118, l’elemento più pesante della tavola periodica degli elementi.
Riempi gli Orbitali per l’Atomo desiderato
Per scrivere la configurazione elettronica per un atomo specifico, devi riempire gli orbitali nell’ordine corretto fino a quando hai posizionato tutti gli elettroni dell’atomo. Ad esempio, per scrivere la configurazione elettronica di un atomo neutro di calcio (numero atomico 20), devi riempire gli orbitali nell’ordine sopra descritto fino a quando hai posizionato tutti e 20 gli elettroni.
L’orbitale 1s può contenere un massimo di 2 elettroni e quindi ha due elettroni. L’orbitale 2s può contenere un massimo di 2 elettroni e quindi ha due elettroni. L’orbitale 2p può contenere un massimo di 6 elettroni e quindi ha sei elettroni. L’orbitale 3s può contenere un massimo di 6 elettroni e quindi ha sei elettroni. L’orbitale 4s può contenere un massimo di 2 elettroni e quindi ha due elettroni. Sommando tutti gli elettroni si ottiene 20, il numero atomico del calcio.
Quindi, la configurazione elettronica dell’atomo di calcio neutro sarà: 1s2 2s2 2p6 3s2 3p6 4s2.
È importante notare che il livello energetico degli orbitali cambia man mano che si sale nella tavola periodica degli elementi. Ad esempio, quando si salta al quarto livello energetico, prima viene l’orbit
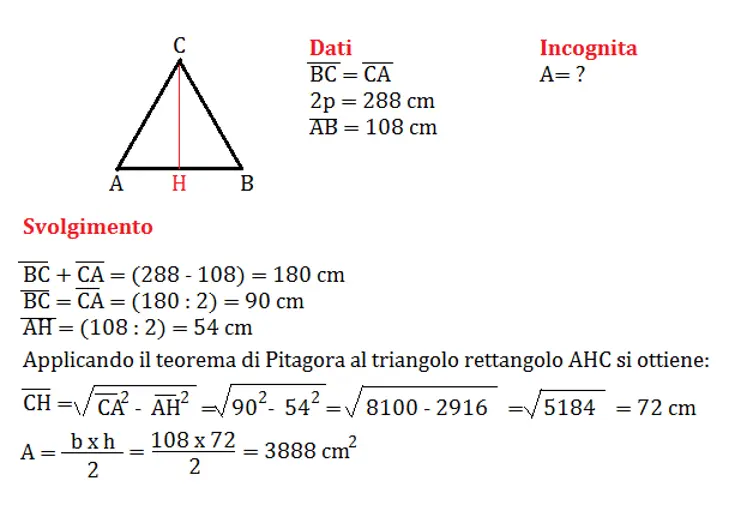
Utilizzo della tavola periodica per scrivere la configurazione elettronica
La tavola periodica degli elementi è un utile strumento per scrivere la configurazione elettronica. La posizione di un elemento nella tavola periodica corrisponde all’ordine degli orbitali nella sua configurazione elettronica.
Le due colonne più a sinistra rappresentano gli atomi la cui configurazione finisce con un orbitale s, mentre il blocco a destra rappresenta gli atomi la cui configurazione termina con un orbitale p. La sezione centrale della tavola periodica contiene gli atomi che hanno una configurazione che termina con un orbitale d, mentre la porzione inferiore della tavola periodica contiene atomi con una configurazione che finisce con un orbitale f.
Per esempio, per scrivere la configurazione elettronica del cloro, basta guardare la sua posizione nella tavola periodica: si trova nella terza riga (o “periodo”) della tavola periodica e nella quinta colonna, quindi la sua configurazione termina con 3p5.
È importante notare che gli orbitali d ed f degli elementi della tavola periodica hanno livelli energetici diversi rispetto al periodo in cui sono inseriti.
Utilizzo di un gas nobile come scorciatoia
Per scrivere la configurazione elettronica di elementi più grandi e con un maggior numero di elettroni, è possibile utilizzare un gas nobile come scorciatoia. Gli atomi di gas nobili sono molto stabili e hanno una configurazione elettronica completa nella loro shell esterna.
Per scrivere la configurazione elettronica dello zinco (numero atomico 30), ad esempio, si può utilizzare l’argon come scorciatoia: la configurazione completa dello zinco è 1s2 2s2 2p6 3s2 3p6 4s2 3d10, ma 1s2 2s2 2p6 3s2 3p6 corrisponde alla configurazione dell’argon. Pertanto, si può sostituire questa parte della configurazione con il simbolo dell’argon racchiuso tra parentesi quadre ([Ar]).
Quindi la configurazione elettronica dello zinco diventa [Ar]4s2 3d10.
Il metodo alternativo per scrivere le configurazioni elettroniche
Esiste un metodo alternativo per scrivere le configurazioni elettroniche, che non richiede né memorizzazione, né diagrammi mnemonici. Questo metodo utilizza una tavola periodica modificata chiamata ADOMAH, sviluppata da Valery Tsimmerman, disponibile sul sito (www.perfectperiodictable.com/Images/Binder1).
Nella tavola periodica ADOMAH, le righe orizzontali rappresentano i gruppi di elementi, come ad esempio gli alogeni, i gas nobili, i metalli alcalini, le terre alcaline, ecc. Le colonne verticali, invece, corrispondono ai gusci elettronici e le “cascate” rappresentano i periodi, unendo i blocchi s, p, d e f con linee diagonali.
L’elio si trova vicino all’idrogeno perché entrambi hanno elettroni localizzati nello stesso orbitale. I blocchi dei periodi (s, p, d e f) si trovano sulla destra, mentre i numeri dei gusci si trovano in basso. Gli elementi sono rappresentati in rettangoli numerati da 1 a 120. Questi numeri atomici rappresentano il numero totale di elettroni in un atomo neutro.
Per scrivere la configurazione elettronica di un elemento con il metodo ADOMAH, è necessario stampare una copia della tavola periodica modificata e cercare il simbolo dell’elemento nella tavola. Successivamente, bisogna cancellare tutti gli elementi che hanno un numero atomico più alto di quello dell’elemento in questione. Ad esempio, se devi scrivere la configurazione elettronica dell’erbio (68), cancella gli elementi dal 69 al 120.
Considera poi i numeri dall’1 all’8 alla base della tavola, corrispondenti ai numeri dei gusci elettronici o alle colonne. Non considerare le colonne in cui tutti gli elementi sono stati cancellati. In questo caso, per l’erbio, le colonne rimanenti sono 1, 2, 3, 4, 5 e 6.
Metodo ADOMAH per scrivere le configurazioni elettroniche
Il metodo ADOMAH, sviluppato da Valery Tsimmerman, utilizza una tavola periodica modificata che permette di scrivere le configurazioni elettroniche degli elementi senza memorizzare schemi complessi o diagrammi. La tavola periodica ADOMAH presenta le righe orizzontali come gruppi di elementi (ad esempio alogeni, gas nobili, metalli alcalini, terre alcaline, ecc.), mentre le colonne verticali corrispondono ai gusci elettronici e le cosiddette “cascate” rappresentano i periodi.
Per utilizzare il metodo ADOMAH, si cerca il simbolo dell’elemento nella tavola periodica e si cancellano tutti gli elementi che hanno un numero atomico più alto. Successivamente, si considerano i simboli dei blocchi sulla destra della tavola (s,p,d,f) e i numeri delle colonne in basso, separando le colonne in coppie colonna-blocco e ordinandole dal basso verso l’alto. Le coppie colonna-blocco si scrivono partendo dal numero delle colonne seguito dal simbolo del blocco, come indicato qui: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (nel caso dell’erbio). Si conta poi il numero di elementi che non sono stati cancellati in ogni blocco-colonna e si scrive questo numero vicino al simbolo del blocco.
Eccezioni comuni
Esistono diciotto eccezioni comuni alle configurazioni elettroniche degli atomi nel livello energetico più basso, definito stato base. In queste eccezioni, gli elettroni si discostano dalla regola generale solo nella penultima e terzultima posizione. Qui di seguito sono riportati gli esempi delle configurazioni elettroniche degli atomi che presentano tali eccezioni:
- Cromo (…, 3d5, 4s1)
- Rame (…, 3d10, 4s1)
- Niobio (…, 4d4, 5s1)
- Molibdeno (…, 4d5, 5s1)
- Ruthenio (…, 4d7, 5s1)
- Rodio (…, 4d8, 5s1)
- Palladio (…, 4d10, 5s0)
- Argento (…, 4d10, 5s1)
- Lantanio (…, 5d1, 6s2)
- Cerio (…, 4f1, 5d1, 6s2)
- Gadolinio (…, 4f7, 5d1, 6s2)
- Oro (…, 5d10, 6s1)
- Attinio (…, 6d1, 7s2)
- Torio (…, 6d2, 7s2)
- Protoattinio (…, 5f2, 6d1, 7s2)
- Uranio (…, 5f3, 6d1, 7s2)
- Nettunio (…,
Trovare il numero atomico di un elemento dalla configurazione elettronica
Per trovare il numero atomico di un elemento dato la configurazione elettronica, somma i numeri che seguono le lettere (s, p, d, e f). Questo funziona solo per atomi neutri. Nel caso di ioni, devi aggiungere o sottrarre gli elettroni in base alla carica dell’ione. Ricorda che i numeri che seguono le lettere sono degli apici.
Gestire la configurazione elettronica degli ioni
Quando si lavora con un ione, il numero di protoni non corrisponde a quello degli elettroni a causa della carica. La carica si esprime solitamente in alto a destra del simbolo chimico. Quando la configurazione di un atomo neutro termina con qualcosa di diverso da un orbitale s o p, non puoi togliere gli elettroni da questi orbitali di valenza. Ad esempio, se l’atomo ha una configurazione terminante in 4s2 3d7 e una carica +2, la configurazione diventa 4s0 3d7. La configurazione elettronica di un atomo tende verso la stabilità, che si raggiunge quando gli orbitali s e p sono completi (s2 e p6). Quindi, se la configurazione termina con 3p4, servono solo altri due elettroni per diventare stabili. Gli orbitali con configurazioni a metà (s1, p3, d5) sono più stabili rispetto a quelli con configurazioni incomplete come p4 o p2.
Scrivere la configurazione elettronica in modo alternativo
La configurazione elettronica può essere scritta in ordine ascendente di gusci elettronici o in ordine di riempimento degli orbitali. Puoi anche scrivere solo la configurazione di valenza, che consiste negli ultimi orbitali s e p. Tuttavia, per gli ioni, la compilazione della configurazione elettronica dipende dal numero di elettroni e dal punto in cui si è iniziato a saltare i livelli.
La promozione degli elettroni
La promozione degli elettroni si verifica quando un orbitale manca di un solo elettrone per essere completo. In questo caso, prendi un elettrone dall’orbitale s o p più vicino e spostalo nell’orbitale incompleto.
Stai guardando: Guida alla scrittura della configurazione elettronica degli elementi